La Piedra Filosofal era el objetivo principal de la Alquimia, la pseudociencia anterior al desarrollo de la Química como Ciencia. Esta sustancia sería capaz de rejuvenecer e incluso conceder la inmortalidad al que la poseyera, pero su aplicación principal sería transformar cualquier metal de poco valor, como el plomo, en plata u oro. Durante años, los alquimistas engañaron a ricos y poderosos para que financiaran sus estudios con el pretexto de encontrar la Piedra Filosofal que, evidentemente, no se encontró nunca. En la actualidad, y gracias a aceleradores de partículas es posible transmutar átomos de plomo en átomos de oro, pero a un precio desorbitado.

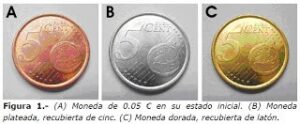
Hay una experiencia de laboratorio en la que se realiza otro engaño para pequeños muggles incautos y que está basada en reacciones químicas sencillas, en la que se transforma una moneda de cinco céntimos de euro, que están hechas de acero recubierto de una fina capa de cobre, en monedas que parecen de plata u oro.
En primer lugar, se disponen las monedas en una cápsula de porcelana y se añaden unos mililitros de disolución de ácido clorhídrico 1 M para eliminar la capa de óxido de cobre que recubre a las monedas usadas. Una vez limpias, se lavan con agua y se reservan. Por otro lado, se pesan 8 g de NaOH en lentejas y se disuelven en unos 100 ml de agua. Cuando se haya disuelto el hidróxido de sodio, se añaden unos 5 g de cinc metálico, en forma de granalla, pequeños trocitos, unos 5 g de sulfato de cinc y se calienta. Se están producido las siguientes reacciones:
Zn(s) + 2 NaOH(ac) –>Na2ZnO2(ac) + H2(g)
ZnSO4(ac) + 4 NaOH(ac) –> Na2ZnO2(ac) + Na2SO4(ac) +2H2O
En la primera reacción, parte del Zn metálico, en estado de oxidación 0, se ha oxidado a cincato, en estado de oxidación 2, mientras que el hidrógeno del hidróxido, en estado de oxidación 1, se ha reducido a hidrógeno elemental, en estado de oxidación 0. En la segunda reacción, el Zn2+ proveniente del sulfato también es transformado en cincato mediante una reacción ácido-base.
Se sumergen las monedas en esta disolución y se calientan durante unos minutos. Se observa como las monedas adquieren un color plateado. Esto se debe a la reducción del cincato sobre el cobre, que actúa de cátodo, transfiriendo los electrones que provienen de la oxidación del cinc restante, que actúa como ánodo:
Reducción (cátodo de Cu (moneda)):
ZnO22- + 2 H2O + 2e– –> Zn + 4 OH–
Oxidación (ánodo de Zn (granalla)):
Zn + 4 OH– – 2e– –> ZnO22- + 2H2O
El resultado es el depósito de átomos de cinc sobre la superficie de la moneda, dando el aspecto plateado.
Se lavan las monedas con agua y se calientan hasta ver la aparición de una tonalidad dorada. En este caso, se produce un movimiento de átomos de cinc hacia la capa de átomos de cobre para formar una aleación dorada: el latón. Y así tendremos nuestras falsas monedas de oro.
«Sabes, solo alguien que quisiera encontrar la Piedra, encontrarla, pero no utilizarla, sería capaz de conseguirla. De otra forma, se verían haciendo oro o bebiendo el Elixir de la Vida»—Albus Dumbledore