Dimitri Mendeleiev (Museo de la Ciencia de Valladolid)
Dimitri Mendeleiev (Museo de la Ciencia de Valladolid)
La ONU, a través de la UNESCO, ha declarado 2019 como Año Internacional de la Tabla Periódica. Esta declaración hace homenaje a la publicación, un 17 de febrero de 1869, de la ordenación de los elementos propuesta por Dimitri Mendeleiev a la Sociedad Química Rusa, y recogida de forma resumida en Zeitschrift für Chemie.
La necesidad de ordenar los constituyentes básicos de todo lo que nos rodea empieza muy pronto en nuestra Historia. Los cuatro elementos aristotélicos (tierra, agua, fuego y aire) son un primer intento de establecer esos componentes básicos, que caló tan fuerte como idea que perduró hasta llegado el Renacimiento.
Existen precedentes de ordenaciones más científicas de los elementos conocidos anteriores a la tabla de Dimitri Mendeleiev. Con anterioridad, en 1817, J. W. Döbereiner, cuando aún se conocían muy pocos elementos químicos, intuyo la existencia de las tríadas o grupos de elementos con propiedades parecidas, con la característica de que el peso atómico del elemento central era la media aritmética aproximada de los pesos atómicos de los elementos extremos; éste era el caso por ejemplo, del litio, sodio y potasio, o del cloro, bromo y yodo, o del azufre, selenio y telurio. También, A. E. de Chancourtois, en 1862, estableció una hélice telúrica o tornillo telúrico, situando los elementos químicos en orden de pesos atómicos crecientes sobre una hélice, con 16 elementos por vuelta. De esta manera observó que muchos de los elementos de propiedades análogas quedaban ubicados en la generatriz del cilindro, unos encima de otros; enunció de esta manera una ley que decía que las propiedades de los elementos son las propiedades de los números. En 1868, J. A. Newlands había ordenado los elementos en agrupaciones lineales, enunciando su ley de las octavas, en la que afirmaba que si se situaban todos los elementos en un orden creciente de pesos atómicos después de cada siete elementos, aparecía un octavo cuyas propiedades son similares a las del primero, pero Dimitri desconocía este trabajo y por otra parte el suyo lo superó con creces.

Primera Tabla Periódica de Mendeleiev. En ruso, la titula: “Proyecto de sistema de elementos: basado en sus masas atómicas y características químicas”.
En 1869, hace 150 años, este químico ruso publicó la primera versión de la Tabla Periódica con una orientación similar a la actual: que sirviera de guía para entender las propiedades de los elementos y sus compuestos conocidos, y predecir las de futuros compuestos y elementos. La aportación de este químico ruso fue ordenar los elementos en función de su peso atómico, pero, al mismo tiempo, en función de sus valencias, o modos de combinación más habituales. De tal manera que esa ordenación llevaba a una serie de columnas y de filas donde se veían variaciones periódicas de las propiedades. Al mismo tiempo ofrecía la posibilidad de dejar huecos para elementos todavía no encontrados en función de esa variación periódica, prediciendo incluso las propiedades de algunos de ellos. Hay que recordar que en su época solo se conocían 63 elementos. Esos huecos se llenaron posteriormente, confirmando las hipótesis de Mendeleiev (galio, escandio y germanio). Eso sí, no predijo el grupo de los gases nobles, ni de los elementos lantánidos o actínidos. Hay que tener en cuenta la falta de seguridad y precisión sobre los pesos atómicos en aquella época. Simultáneamente a Mendeléiev, pero de forma independiente, J. L. Meyer llegó a una clasificación prácticamente igual, pero este último se basó en las propiedades físicas de los elementos y no en las químicas como Dmitri Mendeléiev.
La tabla periódica actual no se ordena en función de los pesos atómicos puesto que no existe esa periodicidad regular, sino que se establece en función del número atómico. El número atómico es el número de protones que cada elemento tiene en su núcleo y, a partir de ahí, es también el número de electrones que tiene en su corteza rodeando a dicho núcleo. Son esos electrones, sobre todo los más externos, los que determinan en gran parte la química de cada elemento. Así pues una ordenación más adecuada es en función de ese número atómico. Esta distribución de la tabla tal y como la conocemos ahora, con columnas y filas ordenadas de izquierda a derecha, grupos y periodos, todavía está en discusión para que nos permita tener una ordenación más correcta en cuanto a propiedades atómicas y macroscópicas.
 Tabla Periódica de la Facultad de CC. y TT. Químicas de Ciudad Real.
Tabla Periódica de la Facultad de CC. y TT. Químicas de Ciudad Real.
Recientemente, la IUPAC ha confirmado el nombre de los últimos elementos obtenidos, nihonio, moscovio, teneso y oganesón. Estos elementos, artificiales y obtenidos mediante aceleradores de partículas y reactores nucleares, terminan el período 7 de la Tabla Periódica. Ya ha comenzado la búsqueda de los elementos ultrapesados.
En estas semanas, se han publicado las dos mitades de una entrevista en la más que recomendable página de divulgación científica Cienciaes.com, dirigida por el físico y divulgador científico Ángel Rodríguez Lozano para llegar a todo aquel que sienta inquietud por el estudio de la Naturaleza y las leyes que la gobiernan. En esa entrevista, intentamos hacer nuestro pequeño homenaje a esta efemérides y hablar de los elementos a lo largo de la Historia.
http://cienciaes.com/entrevistas/2019/03/25/tabla-periodica-1/
http://cienciaes.com/entrevistas/2019/04/01/tabla-periodica-2/
https/podcast/hablando-con-cientificos-cienciaes.com/id304214854?mt=2
http://www.ivoox.com/podcast-hablando-cientificos_sq_f11448_1.html
https://www.facebook.com/cienciaes
https://www.facebook.com/groups/435745970117/
https://twitter.com/cienciaes/






 Dimitri Mendeleiev (
Dimitri Mendeleiev (

 Niklas Elmehed. © Nobel Media
Niklas Elmehed. © Nobel Media






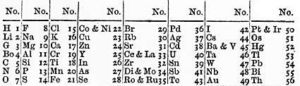 De John Alexander Reina Newlands - John Alexander Reina Newlands (1838–1898),
De John Alexander Reina Newlands - John Alexander Reina Newlands (1838–1898),