Hay tres palabras relacionadas con este elemento del grupo 4 que pueden causar confusión (y en inglés, más). Está el propio elemento, zirconio o circonio, un metal. El zircón, silicato de zirconio, ZrSiO4, y la zirconita, el óxido, ZrO2, estas últimas utilizadas como piedras semipreciosas. En concreto, las zirconitas simulan a los diamantes. Una manera de diferenciarlos fácilmente es poner la joya en cuestión en el labio inferior. Si no se siente nada, es zirconita. Si se siente frío, es diamante, que es mejor conductor.

Una de las aplicaciones principales del elemento es su uso en vainas de uranio para reactores nucleares. Este zirconio debe ser muy puro, sin apenas hafnio, su hermano de grupo y de gran parecido químico, ya que el zirconio es bastante “permeable” a los neutrones generados en la reacción de fisión, mientras que el isótopo hafnio-178 es muy eficaz como captador de neutrones, para transformarse en hafnio-179. Es por eso que las barras de control intermedias de los reactores, que permiten controlar la reacción de fisión, contienen hafnio.
Un grave problema que ocurre en los grandes accidentes en plantas nucleares es que, en frío, el zirconio reacciona muy despacio con el oxígeno pero, en caliente, la reacción con el agua es muy vigorosa, formándose el óxido y liberando hidrógeno que, a su vez, puede arder muy fácilmente en esas condiciones, liberando aún más energía.
Zr + H2O –> ZrO2 + H2 H2 + O2 –> H2O + ENERGÍA
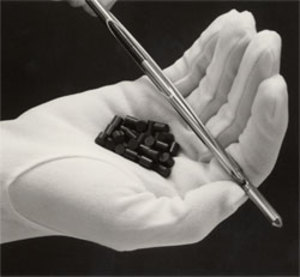
Vaina de aleación de zirconio y pastillas de combustible nuclear UO2. Foto bajo Creative Commons
Un accidente con entrada de agua hacia las vainas la pondría en contacto con el zirconio. Al parecer, algo así ocurrió en el accidente nuclear de Fukushima (Japón) en 2011. El tsunami producido por un movimiento sísmico en el interior del mar dio lugar a graves fallos en los sistemas de refrigeración de varias unidades, lo que provocó un aumento de la temperatura del agua de refrigeración de algún núcleo. Cuando el agua se evaporó, la temperatura en el núcleo subió lo suficiente como para hacer efectiva la oxidación del zirconio. Cuando el hidrógeno producido alcanzó la concentración suficiente y fue expulsado a una zona con aire, se produjo su explosión, dañando gravemente la estructura del edificio de contención. Esto provocó una fácil emisión de gases radiactivos, fundamentalmente yodo-131, altamente tóxicos para las personas (efecto sobre la tiroides).