Unas de las propiedades más destacadas de los complejos de metales de transición es la variedad de colores que suelen presentar. Estos colores se deben a múltiples factores, pero uno de ellos es la diferencia en el desdoblamiento que se produce entre los orbitales d del centro metálico. Esta diferencia en el desdoblamiento está influida por el tipo de metal, su estado de oxidación, la naturaleza de los ligandos, o la geometría del complejo.

Por ejemplo, el cambio del hexaacuo ion de hierro (III) al complejo trisquelato con ligandos oxalato, produce un cambio desde un amarillo-pardo a un verde brillante.
En los clásicos complejos de cobalto (III), ya descritos por Werner, el cambio en los colores es muy fácil de interpretar.

El complejo con ligandos cloro, es tetraédrico, con un desdoblamiento pequeño, y el color de sus disoluciones es azul. El acuocomplejo, octaédrico, con un desdoblamiento mayor, es rosa casi magenta. Para acabar, el complejo con amoníaco, también octaédrico, pero con un desdoblamiento mayor, debido al menor carácter dador de ese ligando, es de color marrón rojizo.
Archivo del Autor: FERNANDO CARRILLO HERMOSILLA
La expansión de la Química Inorgánica
En 1866, nace Alfred Werner en la ciudad de Mulhouse, en la Alsacia, un rincón entre Francia, Alemania y Suiza. Este químico vocacional acabó siendo catedrático en Zúrich con solo 29 años. Para ese momento, ya había estudiado lo que denominaba la «valencia secundaria». Su propuesta era, frente a la «valencia primaria» de todo elemento, que ahora denominamos estado de oxidación, la existencia de otra valencia secundaria, o de coordinación, que indicaba la posibilidad de rodearse de un número de átomos, iones o moléculas neutras, ordenadas espacialmente con unas estereoquímicas determinadas. Es lo que ahora conocemos como enlace y esfera de coordinación de un centro metálico. Sus estudios con complejos amoniacales de cobalto suponen el comienzo de la Química de la Coordinación. En estos estudios observó la gran tendencia al índice de coordinación 6, con geometría octaédrica, o la posibilidad de compuestos quirales más allá de la Química del carbono.
En 1913, recibió el Premio Nobel de Química por lo que suponía como inicio para el desarrollo de la Química Inorgánica moderna, que ha llegado hasta nuestros días, con las múltiples aplicaciones de los complejos de coordinación, desde la catálisis a la medicina.
«The Nobel Prize in Chemistry 1913 was awarded to Alfred Werner «in recognition of his work on the linkage of atoms in molecules by which he has thrown new light on earlier investigations and opened up new fields of research especially in inorganic» (Texto de la concesión del Premio Nobel)
Pelotas de golf, pelotas de playa
 Una de las teorías más aplicables y fáciles de usar, pero algo difícil de explicar, es la teoría de ácidos y bases duros y blandos, propuesta por Pearson en el año 1963. Según esta teoría, se observa una tendencia a la formación de aductos ácido-base de Lewis estables entre determinados cationes y determinados aniones. Observando esa preferencia, se observa que cationes pequeños y muy cargados, con una concentración de carga positiva alta, tienden a formar compuestos estables con aniones pequeños, de elementos muy electronegativos. Por otro lado, cationes grandes, con menor concentración espacial de carga, tienden a unirse a aniones voluminosos y de átomos menos electronegativos. Pearson propone la denominación de duros para los primeros, como pequeñas bolas de golf, y de blandos para los segundos, como blanditos balones de playa, de tal forma que los aductos duro-duro y blando-blando son especialmente estables. También se forman mixtos, pero serán menos estables termodinámicamente.
Una de las teorías más aplicables y fáciles de usar, pero algo difícil de explicar, es la teoría de ácidos y bases duros y blandos, propuesta por Pearson en el año 1963. Según esta teoría, se observa una tendencia a la formación de aductos ácido-base de Lewis estables entre determinados cationes y determinados aniones. Observando esa preferencia, se observa que cationes pequeños y muy cargados, con una concentración de carga positiva alta, tienden a formar compuestos estables con aniones pequeños, de elementos muy electronegativos. Por otro lado, cationes grandes, con menor concentración espacial de carga, tienden a unirse a aniones voluminosos y de átomos menos electronegativos. Pearson propone la denominación de duros para los primeros, como pequeñas bolas de golf, y de blandos para los segundos, como blanditos balones de playa, de tal forma que los aductos duro-duro y blando-blando son especialmente estables. También se forman mixtos, pero serán menos estables termodinámicamente.
Un efecto de este diferente comportamiento lo encontramos, por ejemplo, en los cationes hidratados. El catión de litio es más pequeño que el de sodio, pero sus formas hidratadas tienen tamaños contrarios. Esto ocurre porque el catión de litio es más pequeño, más duro, y atrae más a las moléculas de agua, formando enlaces más fuertes. En el caso del sodio, los enlaces son más lábiles y las moléculas de agua se pierden con facilidad.
Por si eran pocos
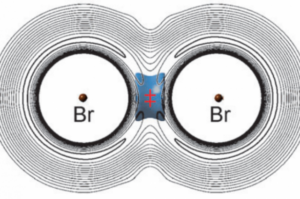 Después de intentar diferenciar con claridad los tipos tradicionales de enlace, covalente, iónico y metálico, aprendemos que tenemos que tener en cuenta, además, las importantes fuerzas de enlace intermoleculares, tipo Van der Waals, o los enlaces de hidrógeno. Pues ahora tendremos que añadir un tipo más: el vibracional. Recientemente, un equipo internacional ha demostrado la posibilidad de un enlace de este tipo en el sistema BrMuBr, donde Mu es el símbolo del muonio, un isótopo ligero del hidrógeno, formado por un antimuon y un electrón. El antimuon es la antipartícula del muon, es decir la forma positiva del muon que, a su vez, es una partícula elemental similar al electrón en carga, pero mucho más pesada, cercana al protón.
Después de intentar diferenciar con claridad los tipos tradicionales de enlace, covalente, iónico y metálico, aprendemos que tenemos que tener en cuenta, además, las importantes fuerzas de enlace intermoleculares, tipo Van der Waals, o los enlaces de hidrógeno. Pues ahora tendremos que añadir un tipo más: el vibracional. Recientemente, un equipo internacional ha demostrado la posibilidad de un enlace de este tipo en el sistema BrMuBr, donde Mu es el símbolo del muonio, un isótopo ligero del hidrógeno, formado por un antimuon y un electrón. El antimuon es la antipartícula del muon, es decir la forma positiva del muon que, a su vez, es una partícula elemental similar al electrón en carga, pero mucho más pesada, cercana al protón.
En este nuevo tipo de enlace, el muonio está «saltando» de un bromo al otro, lo que permite compensar el aumento de energía potencial, que estaría en contra de la formación del enlace.
El iridio en lo más alto
 Hasta finales del año 2014, cuando en clase se hablaba de los posibles estados de oxidación de los elementos y, en concreto, de los metales de transición, se comentaba que el estado de oxidación 8 era el máximo posible, en compuestos como RuO4, IrO4, XeO4 y, por tener utilidad en Química Orgánica, el OsO4.
Hasta finales del año 2014, cuando en clase se hablaba de los posibles estados de oxidación de los elementos y, en concreto, de los metales de transición, se comentaba que el estado de oxidación 8 era el máximo posible, en compuestos como RuO4, IrO4, XeO4 y, por tener utilidad en Química Orgánica, el OsO4.
Pero desde ahora, tendremos que sumar una especie química que estará en lo más alto de los estados de oxidación conocidos: IrO4+. Como iridio está en el grupo 9, todavía podía subir un peldaño más a la hora de compartir sus electrones de valencia. Un equipo internacional ha conseguido la gesta de obtener el primer ejemplo de una especie química en estado de oxidación 9 (Nature 2014, DOI: 10.1038/nature13795).
Los metales de transición
La mayor parte de los metales conocidos son metales de transición. Muchos de ellos desde muy antiguo, como el oro, la plata, el cobre, o el más importante, de momento, el hierro. Y muchos otros que encuentran múltiples utilidades, desde la medicina, la catálisis, la joyería, pasando por el armamento o la electrónica.
Según estudiemos los diferentes metales, incluiré nuevos post con temas relacionados, tanto con la química, como con la historia que hay detrás.

Un blog para conectar con la Química

Mi nombre es Fernando Carrillo Hermosilla y trabajo como Catedrático de Química Inorgánica en el Departamento que, además, incluye a Química Orgánica y Bioquímica, dentro de la Facultad de Ciencias y Tecnologías Químicas de Ciudad Real.
Soy Licenciado en Ciencias Químicas por la Universidad de Alcalá (UAH).
Tras finalizar mis estudios en esta universidad, conseguí el título de Doctor en Química por la Universidad de Castilla-La Mancha.
Tras realizar una estancia post-doctoral en el Institut de Recherches sur la Catalyse del CNRS en Lyon (en la actualidad IRCELYON), volví a la UCLM, donde realizo mi actividad docente e investigadora.
En este blog, me propongo mostrar esa docencia y esa investigación, orientada en principio hacia la Química Inorgánica, pero dando cabida a otras expresiones de la Química que puedan ser de interés para lectoras y lectores.
Además, soy el responsable del grupo de investigación COMCat, de la UCLM.
QUÍMICA DE LA COORDINACIÓN Y ORGANOMETÁLICA ORIENTADA A LA CATÁLISIS
Contacto
Dpto. de Química Inorgánica, Orgánica y Bioquímica
Facultad de Ciencias y Tecnologías Químicas
Av. de Camilo José Cela, s/n – 13071 Ciudad Real
Edificio San Alberto Magno, planta primera.
Tfno.: + 34 926 295300 Ext. 3417
e-mail: Fernando.Carrillo@uclm.es